一、注册资格

医疗器械公司在申请注册之前,必须满足一定的条件。首先,它们必须是具有独立法人资格的企业,这意味着它需要有自己的营业执照和税务登记证。其次,企业需要具备相应的生产或进口能力,即能够从事相关医疗器械的设计、研发、生产或进口活动。此外,还需要有一定的资质认证,比如ISO13485等国际标准认证,以证明其质量管理体系的完善性。
二、产品分类
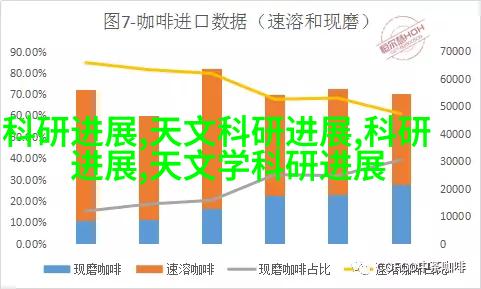
根据中国国家医药监督管理局(NMPA)的规定,医疗器械分为三类:I类、II类和III类。在申请注册时,企业需要明确自己的产品属于哪一类,并且遵循该分类对应的审批流程和要求。其中,I类是指低风险产品,如一次性使用的手术衣物;II类包括中风险产品,如心脏起搏器;III类则是高风险产品,如核磁共振设备。这三个级别决定了不同的审批周期和复杂程度。
三、审批程序
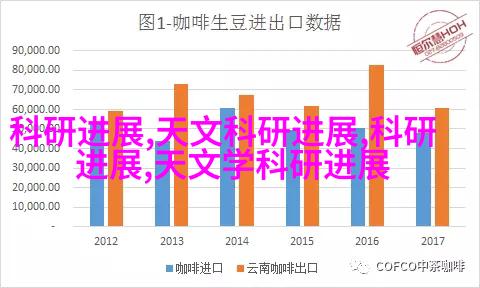
医疗器械公司在提交注册申请后,将会经历一个复杂而严格的审批程序。这包括但不限于技术文件审核、新品申报材料评估以及现场检查等环节。在整个过程中,如果发现任何问题或者不符合规定,都可能导致申请被驳回或者延期。因此,对于每个环节都要精心准备并保证所有资料都能满足法规要求。
四、持续跟踪与更新

获得注册许可只是医疗器械公司工作的一部分。一旦获得许可,他们就要开始进行市场推广和销售。而随着时间推移,一些新的法规可能会出台,也许是一些新技术规范,或是对于某些特定类型设备更多严格限制。这意味着这些公司不得不不断地监控最新信息,并做好必要调整以保持自身合规状态。
五、全球市场扩张

随着全球化趋势加强,一些成功获得中国主管部门批准并成功上市的小型创新初创团队,也开始寻求进入其他国家市场。但这通常涉及到跨国合作伙伴关系,以及适应当地法律法规。此外,还有大量关于数据隐私保护的问题,这对于跨境交易尤为重要,因为不同国家对于个人数据处理存在差异,因此如何平衡不同地区之间互操作性是一个挑战性的议题。



